Gebruiker:Spoorjan/zandbak9/Waterstof
Waterstof[bewerken | brontekst bewerken]
Vloeibare waterstof[bewerken | brontekst bewerken]
Waterstof (LH2 of LH2) is de vloeibare aggregatietoestand van diwaterstof (H2). Om als een vloeistof te kunnen bestaan moet H2 onder druk gezet worden en gekoeld tot de lage temperatuur van 20,28 K (−252,87°C).[1] Vloeibare waterstof bestaat voor 99,79% uit parawaterstof en voor 0,21% uit orthowaterstof.[2]
Waterstof is een proces dat over het algemeen koolwaterstoffen middels een chemische reactie omvormt tot waterstofgas. Hierbij komt het broeikasgas CO2 vrij. Waterstofgas kan ook verkregen worden middels biologische waterstofproductie in een algenbioreactor, of door het gebruik van grote hoeveelheden elektriciteit (door elektrolyse), hitte (thermolyse) of een tussenvorm (hoge-temperatuurelektrolyse). Deze methoden zijn op dit moment niet kosteneffectief voor grote hoeveelheden. Goedkope, massale productie met een duurzame oorsprong is een vereiste voor een gezonde waterstofeconomie.
Waterstoftechniek[bewerken | brontekst bewerken]
Waterstoftechniek is een verzamelnaam voor alle, voor waterstof specifieke, technische aspecten die aan de basis liggen van de waterstofeconomie. In een, voorlopig nog denkbeeldige, waterstofeconomie is waterstofgas de belangrijkste energiedrager.
De belangrijkste onderdelen van de waterstoftechniek zijn: waterstofproductie, waterstofopslag, waterstoftransport en waterstofgebruik.
Bij gebruik van waterstof om warmte of energie op te wekken komt geen kooldioxide vrij. Het gebruik van waterstof geeft daarom geen bijdrage aan het versterken van het broeikaseffect. Bij de productie van waterstof uit organische materialen (zoals aardgas, aardolie of steenkool) komt echter wel kooldioxide vrij. Bij de productie van waterstof uit kernenergie komt radioactief afval vrij. Bij de productie van waterstof uit duurzame bronnen komt geen kooldioxide vrij.
Vaste waterstof[bewerken | brontekst bewerken]
Vaste waterstof is de vaste aggregatietoestand van waterstof. Deze wordt bereikt door de waterstof af te koelen tot onder het smeltpunt bij 14,01 K (−259,14 °C, bij atmosferische druk). De Schotse fysicus en chemicus James Dewar was in 1899 de eerste die deze temperatuur bereikte en vaste waterstof bereidde; hij publiceerde zijn vondst in het Franse wetenschappelijke tijdschrift Annales de chimie et de physique (ser. 7, vol. 18, oktober 1899) onder de titel 'Sur la solidification de l'hydrogène'.[3] Het jaar daarvoor had Dewar als eerste vloeibare waterstof gemaakt.
Bij zeer hoge druk gaat waterstof waarschijnlijk over in een toestand met de eigenschappen van een metaal. Men spreekt dan van metallische waterstof, die zowel vast (kristallijn) als vloeibaar kan zijn, afhankelijk van de temperatuur en de druk.
Vanuit koolwaterstoffen[bewerken | brontekst bewerken]
Waterstofgas kan verkregen worden uit aardgas met ongeveer 80% rendement, of vanuit andere koolwaterstoffen, waarbij het rendement varieert. Deze manier van het verkrijgen van waterstofgas stoot broeikasgassen uit. Omdat de productie op één plaats geconcentreerd kan worden, is het mogelijk deze gassen op een nette manier af te werken, bijvoorbeeld door deze terug te pompen in een olie- of gasveld, alhoewel deze methode nog niet vaak wordt toegepast. Een CO2-injectieproject is gestart door het Noorse bedrijf Statoil in het Sleipnerveld, gelegen in de Noordzee.
Stoomreforming[bewerken | brontekst bewerken]
Waterstofgas wordt voor commerciële toepassingen vaak in grote hoeveelheden geproduceerd door middel van reforming van aardgas. Op hoge temperaturen (700-1100°C), reageert stoom (H2O) met methaan (CH4). Deze reactie heeft als product syngas.
De vereiste hitte voor dit proces wordt gewoonlijk verkregen uit het verbranden van een deel van het methaan.
CO[bewerken | brontekst bewerken]

Meer waterstofgas kan worden verkregen uit het CO via water-gassplitsing, dat plaatsvindt op ongeveer 130°C.
- CO + H2O → CO2 + H2 + 40.4 kJ/mol
Hierbij wordt het zuurstofatoom vanuit het water gebruikt om koolmonoxide om te vormen naar kooldioxide, waarbij diwaterstof vrijkomt.
Steenkool[bewerken | brontekst bewerken]
Steenkool kan worden omgezet in syngas en methaan (ook wel bekend als stadsgas) door middel van vergassing.
Kværner proces[bewerken | brontekst bewerken]

Het Kværnerproces is een in de jaren 1980 door het Noorse bedrijf Kværner (nu deel van Aker Solutions) ontwikkelde methode voor de productie van waterstof uit koolwaterstoffen (CnHm), zoals methaan, aardgas en biogas.[4]
Principe[bewerken | brontekst bewerken]
De koolwaterstoffen worden in een plasmabrander (vlamboog) op ongeveer 1600°C gesplitst in de componenten koolstof en waterstof.
Reactie:
Het voordeel ten opzichte van andere reformatiemethoden (stoomreforming, gedeeltelijke oxidatie, enz.) is dat het aardgas wordt omgezet in 100% zuivere koolstof en waterstof . De verwerkte energiestroom resulteert in ongeveer 48% waterstof, 40% actieve kool en 10% in stoom.
Variant[bewerken | brontekst bewerken]
In 2009 werd de variant plasmaboogvergassing voor afvalbehandeling gepresenteerd waarbij met behulp van een plasma-boog het methaan en aardgas wordt omgezet in waterstof, warmte en koolstof met behulp van een plasma-omzetter[5].
Mierenzuur[bewerken | brontekst bewerken]
Mierenzuur is bij proeven toegepast als bron voor waterstof voor gebruik in een brandstofcel in auto's. Hierbij wordt het mierenzuur (HCOOH) met een katalysator omgezet in waterstofgas (H2) en CO2. Bij de productie van waterstof uit elektriciteit via mierenzuur gaat ongeveer 55% van de energie verloren, wat vergelijkbaar is met waterstofproductie uit elektrolyse. Het voordeel is dat mierenzuur bij kamertemperatuur vloeibaar is en het volume in vergelijking met waterstofgas dus veel beperkter is.
Waterstof gemaakt vanuit water[bewerken | brontekst bewerken]

Biologische productie[bewerken | brontekst bewerken]
Onder bepaalde omstandigheden produceren algen waterstofgas. In 1997 werd ontdekt dat algen van de productie van zuurstof (via normale fotosynthese) overschakelen op de productie van waterstofgas als zwavel onthouden wordt. In 2007 werd de ontdekking gedaan dat het toevoegen van koper hetzelfde resultaat geeft.
Elektrolyse[bewerken | brontekst bewerken]

Wanneer er gebruik wordt gemaakt van een chemische energiebron, zal het produceren van waterstofgas altijd efficiënter zijn door middel van een directe chemische reactie. Maar wanneer een mechanische manier van energieopwekking zoals waterkracht of windenergie gebruikt wordt, kan het interessant worden om te kijken naar elektrolyse. Over het algemeen is de benodigde energie bij dit proces hoger dan de waarde van het geleverde waterstof, waardoor deze manier van productie niet vaak gebruikt wordt.
Wanneer de energiebron primair warmte levert (zoals bij zonne-energie of kernenergie), is het op dit moment alleen mogelijk waterstofgas te produceren door middel van lage-temperatuurelektrolyse. Daarnaast is er ook een proces dat bekendstaat als hoge-temperatuurelektrolyse (HTE). Dit proces maakt gebruik van de hitte-energie uit de warmtebron om waterstof te verkrijgen. In potentie is hiermee 50% meer efficiëntie te behalen, doordat de energie niet eerst de stap van hitte naar elektriciteit hoeft te maken. HTE is inmiddels succesvol gedemonstreerd in laboratoria, maar nog niet op een schaal die commercieel aantrekkelijk is.
Hoge-drukelektrolyse[bewerken | brontekst bewerken]
Hoge-drukelektrolyse is de elektrolyse van water door de ontleding van water (H2O) in zuurstofgas (O2) en waterstofgas (H2) onder druk op ongeveer 120-200 Bar.
Hoge-temperatuurelektrolyse[bewerken | brontekst bewerken]

Het HTE-proces wordt normaal gesproken alleen overwogen wanneer er kernenergie als warmtebron beschikbaar is, omdat andere niet-chemische vormen van de vereiste warmte te onstabiel zijn (geconcentreerde zonne-energie) om de kosten van een HTE-installatie te verantwoorden. Het doel is dat onderzoek naar HTE- en hogetemperatuurkernreactoren uiteindelijk zal leiden naar een waterstofproductieproces dat kan concurreren met reforming, de techniek wordt niet verwacht voor 2030, daarbij is het niet duidelijk of het in veiligheid en productie kan concurreren met het decentrale opwekkings concept
Een solid oxide electrolyser cell (SOEC) is een solid oxyde fuel cell in regeneratieve modus voor de elektrolyse van water op temperaturen van 500 tot 850°C met een vast oxide of keramiek elektroliet voor de productie van waterstofgas[6].
Toestel van Hofmann[bewerken | brontekst bewerken]
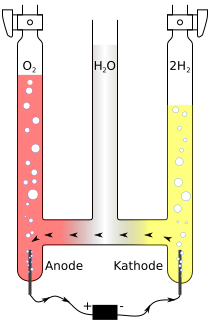
Het Toestel van Hofmann is ontworpen door August Wilhelm von Hofmann. Met dit toestel kan de ontleding van water in waterstof en zuurstof door middel van elektrolyse worden aangetoond.
Het toestel bestaat oorspronkelijk uit drie verticale buizen, die onderaan met een dwarsbuis verbonden zijn. De twee buitenste buizen zijn bovenaan met een kraan afgesloten en hebben onderaan een elektrode die gewoonlijk gemaakt is van platina of grafiet. De middelste buis is van boven open. Het toestel wordt gevuld met gedestilleerd water, dat geleidend wordt gemaakt door toevoeging van een elektrolyt. Vervolgens wordt er tussen de elektroden een elektrische potentiaal aangebracht. Na verloop van tijd zal er zich in de buis boven de anode zuurstof en in de buis boven de kathode waterstof ophopen. Het is duidelijk te zien dat er twee keer zoveel waterstof als zuurstof geproduceerd wordt. De aanwezigheid van de waterstof is aan te tonen door de kraan boven de kathode te openen en er een vlam bij te houden. De waterstof zal verbranden. De aanwezigheid van de zuurstof is aan te tonen door het langs een gloeiende houtspaander te leiden. Er zal spontaan een vlam ontstaan.
In de afbeelding is de werking van het Toestel van Hofmann uitgebeeld. De kleuring treedt op door toevoeging van een pH-indicator zoals methylrood. Methylrood wordt rood in zuur milieu en geel in een basisch milieu.
Aan de anode vindt de volgende reactie plaats:
Door de vorming van H+ is het milieu aan de anode zuur.
Aan de kathode vindt de volgende reactie plaats:
Door de vorming van OH– is het milieu aan de kathode basisch.
Thermochemische productie[bewerken | brontekst bewerken]
Er zijn meer dan 200 thermochemische processen bekend om waterstofgas te produceren[7], deze kunnen door hitte water ontbinden in waterstofgas en zuurstofgas zonder elektrische energie. Omdat de enige benodigde energie hiervoor in de vorm van hitte vrijkomt, kan dit proces nog efficiënter zijn dan HTE. Een dozijn van deze processen zoals de cerium(IV)oxide-cerium(III)oxide-cyclus, zink zinkoxide cyclus, zwavel-jodium cyclus worden onderzocht en zijn in testfase, geen van deze thermochemische processen zijn gedemonstreerd op een massaproductie niveau, hoewel er verschillende demonstraties in laboratoria hebben plaatsgevonden.
Fotokatalytische productie[bewerken | brontekst bewerken]
In plaats van het produceren van waterstof uit de elektriciteit uit bijvoorbeeld zonnecellen is het efficiënter om dit direct te doen. Er wordt op dit moment onderzoek gedaan naar deze nieuwe technologie, fotokatalytische waterstofproductie die gebaseerd is op de fotokatalyse reactie. De technologie maakt gebruik van een foto-elektrochemische cel.
Andere methode[bewerken | brontekst bewerken]
Er bestaan theorieën over de aanwezigheid van waterstofgas in de aardkorst, dit zou het boren naar waterstof mogelijk maken, zoals er op dit moment olie en gas geboord worden. Zie externe bronnen.
Waterstofopslag[bewerken | brontekst bewerken]

Waterstofopslag beschrijft de methodologie om waterstofgas (H2) op te slaan om daarna weer vrij te laten komen en te gebruiken. Hiervoor bestaan diverse methoden, zoals het gebruik van hoge drukken en zeer lage temperaturen (vloeibare waterstof) in waterstoftanks. In de industrie wordt nu veelal onder hoge druk opgeslagen. Veel onderzoek richt zich echter op chemische stoffen die H2 opnemen en ook weer kunnen vrijgeven door verwarming.
Waterstofopslag is een belangrijk onderwerp in de waterstofeconomie. Men zoekt vooral naar lichte, compacte componenten om waterstof in op te slaan, met het oog op draagbare of mobiele toepassingen. Vergelijk het hierbij met koolwaterstoffen die als brandstof worden opgeslagen in tanks en gasflessen. Aardgas wordt bijvoorbeeld ook in zijn vloeibare vorm (sterk afgekoeld) vervoerd. Met de huidige technologie is het echter moeilijk om waterstofgas op te slaan of te vervoeren. Dit komt doordat waterstofgas weinig energie per volume-eenheid oplevert in vergelijking met butaangas of propaangas. Om een gelijke hoeveelheid energie aan waterstofgas te vervoeren is er dus een grotere tank nodig. Waterstof gas kan niet in een vloeibare toestand blijven door het enkel onder hoge druk te houden.
Waterstof als brandstof[bewerken | brontekst bewerken]
Waterstof is een veelbelovend medium voor de opslag en transport van energie. Dit omdat er bij de omzetting van waterstofgas naar energie alleen water vrijkomt als reactieproduct. Koolwaterstoffen produceren bij hun verbranding ook het broeikasgas CO2. Met de opwarming van de aarde in het achterhoofd is het dus nuttig om onderzoek te verrichten naar hoe waterstof kan worden opgeslagen.
Opslag onder druk[bewerken | brontekst bewerken]
Een veel gebruikte methode om bij het opslaan van waterstof in een waterstoftank het volume te verkleinen is het verhogen van de druk van het waterstofgas. Hier voor worden drukken gebruikt van 200, 350 of 700 bar. Een nadeel van deze opslagmethode is dat er door het comprimeren 6%[8] energie verloren gaat bij gebruik van een ionische compressor of zuigercompressor.
Ondergrondse waterstofopslag[bewerken | brontekst bewerken]
Ondergrondse waterstofopslag is de praktijk van de opslag van waterstofgas in ondergrondse grotten[9], zoutkoepels en uitgeputte olie-en gasvelden. Sinds vele jaren worden zonder problemen grote hoeveelheden gasvormige waterstof opgeslagen in ondergrondse grotten door ICI[10]. De elektriciteit die nodig is voor gecomprimeerde waterstofopslag op 200 bar bedraagt 2,1% van de energie-inhoud[11].
Cryogene opslag[bewerken | brontekst bewerken]
De dichtheid van waterstof kan eveneens verhoogd worden door cryogene opslag bij een temperatuur van < 20,28 K (–252,87 °C). In dat geval moeten opslagtanks ook zeer stevig en geïsoleerd zijn. Ook dat zou erg veel onderzoek en geld vergen. De Spaceshuttle werd gelanceerd met de Space Shuttle external tank, die de motoren van de shuttle zelf voorziet van vloeibare waterstof. Het proces om waterstof vloeibaar te maken kost ongeveer en kwart van de energie die in de waterstof opgeslagen is.
Metaal hydriden[bewerken | brontekst bewerken]
Metaalhydriden bevatten interstitiële holtes waarin waterstofgas kan worden opgenomen. Het element palladium wordt bijvoorbeeld gebruikt om waterstofgas op te nemen en weer af te geven, waardoor het gas gezuiverd wordt. Palladium kan tot 900 keer zijn eigen volume aan waterstof opnemen. Als gas is waterstof makkelijk samendrukbaar en de maat "zoveel keer zijn eigen volume" is niet echt indicatief. Daarom drukt men de opslagcapaciteit van een stof liever uit in een percentage van zijn eigen massa. Magnesiumverbindingen kunnen bijvoorbeeld 6% van hun massa aan waterstof opnemen en die bij kamertemperatuur terug afstaan. Recent werd ook aangetoond dat er stikstofhoudende verbindingen zijn die 10% van hun massa aan waterstof kan opnemen.
Bij de opslag van waterstof kan er een verbinding gevormd worden met waterstof als anion.
Nanovezels[bewerken | brontekst bewerken]
Een recentere manier om waterstof op te slaan is het gebruik van koolstofnetwerken met deeltjes van 10 tot 30 nanometer groot.
Externe links[bewerken | brontekst bewerken]
- Kennislink: Waterstofopslag beter met nanodeeltjes
- Onderzoek door TU Eindhoven: waterstofopslagmaterialen
Toepassingen van waterstof[bewerken | brontekst bewerken]
Waterstof uit de lucht: Belgen presenteren speciaal zonnepaneel[bewerken | brontekst bewerken]
Het is Belgische wetenschappers gelukt om een zonnepaneel te ontwikkelen dat waterstofgas (Diwaterstof) maakt. De onderzoekers van de universiteit in Leuven hebben er tien jaar aan gewerkt.
Het werkt zo: het paneel neemt vocht uit de lucht op. Samen met de elektriciteit uit zonlicht wordt dat omgezet in waterstofgas. Waterstofgas kan zowel elektriciteit als warmte opslaan en produceren. Daarmee kan in de zomer een voorraad worden aangelegd voor de winter.
Met een paneel wordt 15 procent van het zonlicht omgezet in waterstofgas, gemiddeld 250 liter per dag. Volgens de onderzoekers is dat een wereldrecord.
Waterstof ontstaat als water wordt gesplitst in zuurstofgas en waterstofgas. Voor die splitsing is energie nodig. Als daarvoor groene energie wordt gebruikt, is sprake van duurzame productie van waterstof. Bij het gebruik van waterstof komen geen broeikasgassen vrij.
Met twintig 'waterstofpanelen' kan een gezin een heel jaar van stroom en warmte worden voorzien. Wie een auto heeft die op waterstof rijdt, heeft nog eens twintig panelen nodig. De eerste komen bij wijze van proef op een huis in het plaatsje Oud-Heverlee te liggen.
Huishoudens die gebruik willen maken van de techniek hebben uiteindelijk ook een opslagtank nodig. Wat het gaat kosten, is nog niet bekend.
Ad van Wijk, professor Future Energy Systems aan de TU Delft, is enthousiast over de toepassingen van waterstof en het project van de Belgen. "Het rendement is nu 15 procent maar dit systeem is nog in ontwikkeling, nog veel te duur en nog lang niet marktrijp. Maar het is hetzelfde type ontwikkeling dat we twintig tot dertig jaar geleden zagen met zonnecellen die elektriciteit maken."
Ook in Nederland wordt gewerkt aan manieren om waterstof uit de lucht te halen. Het Dutch Institute for Fundamental Energy Research, Differ, ontwikkelt samen met autofabrikant Toyota een systeem dat waterdamp absorbeert en zonne-energie gebruikt om die damp op te splitsen in waterstof en zuurstof.
Zowel de Belgische als de Nederlandse methode nemen zonnepanelen als beginpunt en waterstof als doel, alleen is de weg daarnaartoe anders.
"Het lukt in het laboratorium om uit zonlicht en luchtvochtigheid waterstof te produceren", zegt voorlichter Gieljan de Vries van Differ. "Het onderzoeksproject dat nu gaat starten, met subsidie van de Nederlandse onderzoeksfinancier NWO, is erop gericht de apparaten ook buiten te laten werken en de efficiëntie en levensduur te verhogen."
Voor het project is vier jaar uitgetrokken. "En ik verwacht dat we halverwege al een mooie opstelling hebben die buiten getest kan worden", zegt De Vries.
Als het eenmaal mogelijk is om waterstof te produceren, zijn de toepassingen volgens hem vele malen breder dan alleen de auto-industrie. "Uiteindelijk kun je zelfs schone kerosine maken. Dit is echt een steppingstone."
Bron: (nl) Waterstof uit de lucht: Belgen presenteren speciaal zonnepaneel 27-02-2019
Noorwegen: explosie bij waterstoftankstation[bewerken | brontekst bewerken]
Op Pinkstermaandag 10 juni 2019 vond blijkbaar een ontploffing plaats in een waterstoftankstation voor brandstofcelauto's in Sandvika bij Oslo. Totdat de oorzaak duidelijk is, heeft de provider Nel nog tien andere stations gesloten.
++ Dit bericht is bijgewerkt. Je vindt de nieuwe informatie onderaan. ++
Volgens de Noorse media vond de explosie maandag omstreeks 17.30 uur plaats op het Uno X-station in de buitenwijk Sandvika in Oslo. Volgens het bedrijf mogen geen personen worden geschaad. In een media-rapport, echter, de spraak van twee lichtgewonden. "Het is te vroeg om te speculeren over de oorzaak", zei Nel baas Jon André Løkke in een conference call. "Onze hoogste prioriteit is de veilige werking van de stations die we leveren. Uit voorzorg hebben we tijdelijk gesloten tien stations, in afwachting van verdere informatie. "De stations die gesloten zijn gevestigd, volgens de portal" E24 "in Noorwegen, Denemarken en andere landen.
Brandstofcelautochauffeurs in Noorwegen zullen de komende dagen waarschijnlijk wat problemen krijgen, omdat Uno-X de toonaangevende leverancier in het land is. Hoelang de H2-tankstations buiten dienst zijn, is nog niet te voorzien.
Twee experts uit Denemarken zijn 's nachts ingevlogen om lokale reddingsteams te adviseren en de autoriteiten bij te staan bij het technisch onderzoek.
De werkmaatschappij Uno-X Hydrogen is een joint venture van Uno-X, Nel en Praxair. Het getroffen station werd in november 2016 ingewijd en was het eerste exemplaar van een nieuwe generatie benzinestations die Nel had ontwikkeld. Naast een kleiner oppervlak van het gastype station moet worden onderscheiden door een nieuwe indeling: Door de verbeterde koeling van de waterstof, de pomp kan worden tot 50 meter geplaatst ver van de andere componenten.
Update 12.06.2019:
Toyota en Hyundai zijn voorlopig gestopt met de levering van brandstofcelauto's in Noorwegen. Verantwoordelijke managers van beide bedrijven hebben dit bevestigd aan de Noorse media. Zowel Hyundai als Toyota bevestigden dat ze waterstof over het algemeen als veilig beschouwen. De afleveringsstop is eerder om praktische redenen, want zonder de Uno-X-tankstations is tanken niet mogelijk. Toyota bood haar Mirai-klanten aan om een andere auto gratis te huren voor de duur van de sluiting van het benzinestation.
Update 14.06.2019:
Volgens de voorlopige resultaten kunnen de eerste componenten worden uitgesloten als de oorzaak van de explosie. "Op basis van wat we hebben gezien op de site, kunnen we concluderen dat noch de elektrolyse-noch de dispensers gebruikt door de klanten iets te maken met dit incident," zei Geirmund Vislie van security consulting GexCon. De dispenser is de dispenser die door de klant wordt gebruikt.
Het station in Kjørbo ligt aan de elektrolyse en de afgifte van een lage-drukaccumulator, een lagedruk transporteenheid, een hogedruk accumulator, verschillende ventielblokken en waterstoftankstation zelf. Problemen dus nog niet voltooid.
Bovendien is sindsdien bekend dat het incident ook gevolgen heeft in Duitsland: vier van de circa 70 waterstofvulstations zijn buiten gebruik. "Voor ons is de veiligheid van onze klanten en de stationsmedewerkers de topprioriteit", zegt het operatorconsortium H2 Mobility. "We hebben dus al op 10.6. genomen als een preventieve maatregel alle stations van de fabrikant Nel in Duitsland van het net. "Je staat met het bedrijf" in nauw contact met het oog op nieuwe informatie te verkrijgen, met name over de oorzaken."
Update: 20.06.2019:
Het lijkt nu duidelijk dat het incident begon met een waterstoflek. "Op basis van verder onderzoek kunnen we met zekerheid zeggen dat het lek zich heeft voorgedaan in de hogedrukaccumulator," zei Vislie in een nieuwe release, "en we voeren nu onderzoeken uit om de exacte oorzaak van het lek en de ontsteking te begrijpen." bevat zowel door Nel ontwikkelde componenten als onderdelen van derden.
Bron: (de) Norwegen: Explosion an Wasserstoff-Tankstelle Autor: Sebastian Schaal 11.06.2019 - 12:48
Waterstofbrug[bewerken | brontekst bewerken]

(aangegeven met zwarte streepjes)
Een waterstofbrug is een niet-covalente binding tussen een elektronenpaar op een sterk elektronegatief atoom (zuurstof, stikstof of fluor) en een naburig waterstofatoom, gebonden aan een ander sterk elektronegatief atoom. Waterstofbruggen, ook aangeduid als H-bruggen, komen onder meer voor tussen watermoleculen, waar ze van groot belang zijn voor de fysische eigenschappen van water (smeltpunt/kookpunt; oppervlaktespanning). Ze komen echter ook in vele andere stoffen voor. Waterstofbruggen met een of twee fluoratomen zijn zelfs beduidend sterker: in het geval van het bifluoride-ion benaderen zij de sterkte van een covalente binding.
Is een waterstofatoom verbonden aan een atoom met een zeer grote elektronegativiteit, zoals F, O of N (zelfs C in sommige gevallen) dan wordt de binding sterk polair. De elektronenwolk verschuift dan in de richting van F, O of N en dit atoom wordt negatief geladen. Het resultaat is dat het aan F, O, of N verbonden waterstofatoom positief wordt geladen. Omdat het waterstofatoom zo klein is, is de lading erop sterk geconcentreerd, zodat het met grote kracht een naburig dipoolmolecuul (of zelfs een dipool in hetzelfde molecuul) zeer dicht aan kan trekken. De waterstofbruggen zijn ongebruikelijk sterk vergeleken met andere dipool-dipoolkrachten.

(aangegeven met groene streepjes)

(aangegeven met groene streepjes)
Waterstofbruggen kunnen ook gevormd worden tussen waterstofatomen en elementen die een vrij elektronenpaar bezitten, bijvoorbeeld F, O, N en Cl. Hier wordt de waterstofbrug verklaard door de vorming van een polycentrisch molecuulorbitaal (PCMO) over drie atomen: H, het atoom waar H covalent op gebonden is en het atoom waarmee de waterstofbrug aangegaan wordt. Hierbij gaat het p-orbitaal van het atoom met het vrije elektronenpaar een belangrijke rol spelen.
Voorkomen[bewerken | brontekst bewerken]
Waterstofbruggen komen o.a. voor in water en ammoniak, en ze zorgen er ook voor dat de twee strengen van DNA bijeenblijven door de complementaire baseparen te verbinden. De secundaire structuren van eiwitten, zoals de α-helix en de β-plaatstructuur (vouwbladstructuur), worden gevormd door het optreden van waterstofbruggen tussen verschillende peptidebindingen. De waterstofbruggen zijn ook de drijvende kracht achter het al dan niet hydrofiel of hydrofoob zijn van (delen van) moleculen.
Waterstofbruggen treden ook op in alcoholen en amines. Zodra een ethanolmolecuul tussen watermoleculen komt, vormt het waterstofatoom van de hydroxylgroep in ethanol een waterstofbrug met een H2O-molecuul. Hierbij komt energie vrij (het is dus een exotherme reactie), 22 kJ per mol bindingen.
Een speciale plaats wordt ingenomen door intramoleculaire waterstofbruggen: waterstofbruggen binnen hetzelfde molecuul. Ze treden onder andere op in α-hydroxyzuren. In tegenstelling tot de intermoleculaire waterstofbruggen zijn intramoleculaire bruggen zeer stabiel.
Invloed op stofeigenschappen[bewerken | brontekst bewerken]
In ijs zijn de waterstofbruggen verantwoordelijk voor het feit dat ijs van 0 °C een kleinere dichtheid heeft dan water van 0°C. De waterstofbrug O···H—O is namelijk lineair. Dit feit en de veronderstelde sp3-hybridisatie bij het O atoom (tetraëdrische ladingswolken) heeft tot gevolg dat ijs een met diamant vergelijkbare tetraëdrische kristalstructuur heeft, met tussen de watermoleculen relatief veel lege ruimte. Bij het smelten van ijs stort deze structuur gedeeltelijk in en komen de watermoleculen gemiddeld dichter op elkaar te zitten.
Het optreden van waterstofbruggen heeft ook effect op de hoogte van het kookpunt van de verbindingen waarin ze optreden. Water heeft een veel hoger kookpunt dan op grond van zijn plaats in de rij H2X (met X = S, Se, Te, Po) verwacht kan worden. Zo is bijvoorbeeld water H2O een vloeistof, terwijl H2S een gas is bij kamertemperatuur.
De sterkte van de waterstofbrug vertoont een duidelijk isotoopeffect. Dit is goeddeels verantwoordelijk voor het feit dat het smeltpunt van zwaar ijs een aantal graden hoger ligt dan van gewoon ijs en zwaar water zijn hoogste dichtheid bereikt bij ongeveer 11 °C in plaats van ongeveer 4 °C. De vervanging van protonen door deuteronen heeft invloed op de wijze waarop eiwitten zich opvouwen en dit feit wordt gebruikt om het opvouwen van eiwitten te bestuderen.[12]
Deuterium[bewerken | brontekst bewerken]
| Deuterium | ||||
|---|---|---|---|---|

| ||||
| Algemeen | ||||
| Element | waterstof (H) | |||
| Nuclide | 2H | |||
| Aantal protonen | 1 | |||
| Aantal neutronen | 1 | |||
| Nuclidische gegevens | ||||
| Nuclidenmassa | 2,01410177785 u | |||
| Spin | 1+ | |||
| Bindingsenergie | 1,112283 MeV | |||
| Massaoverschot | 13,13572158 MeV | |||
| Isotopen van waterstof | ||||
| ||||
Deuterium of 2H (occasioneel waterstof-2 genoemd) is een stabiele isotoop van waterstof met in de atoomkern een proton en een neutron. In plaats van de gebruikelijke notatie voor isotopen 2H wordt meestal gebruikgemaakt van het symbool D. In tegenstelling tot tritium, een andere isotoop van waterstof, is deuterium stabiel. De abundantie op Aarde is laag: ongeveer 0,015% van alle waterstofatomen is deuterium. Het meest voorkomende isotoop van waterstof is protium (1H). Deuterium werd in 1932 door Harold Urey ontdekt; hiervoor werd hem in 1934 de Nobelprijs voor de Scheikunde toegekend. De waterstof-isotoop deuterium dankt zijn naam aan het het Griekse woord deuteros, dat tweede betekent en daarmee verwijst naar het tweede deeltje in de kern van het waterstofatoom naast een proton: een neutron.
Eigenschappen en toepassingen[bewerken | brontekst bewerken]
De chemische eigenschappen van deuterium zijn nagenoeg gelijk aan die van waterstof. Soms wordt in reactiesnelheden een kinetisch-isotoopeffect gemeten: als in de snelheidsbepalende stap een waterstofatoom wordt overgedragen, verloopt de reactie trager indien H vervangen is door D.
Door de ten opzichte van waterstof haast tweemaal zo grote atoommassa zijn de fysische eigenschappen van veel deuteriumverbindingen echter meetbaar verschillend. Zwaar water (D2O) heeft bijvoorbeeld een vriespunt van ongeveer 4°C en een blokje van zwaarwaterijs zinkt in water naar de bodem. Ook het kookpunt van zwaar water is hoger dan van normaal water.
Van dit verschil in eigenschappen wordt gebruikgemaakt bij de winning van deuterium, bijvoorbeeld bij herhaalde destillatie van water zal het achterblijvende water steeds meer zwaar water bevatten.
Omdat een deuteriumkern – anders dan een protiumkern – een heeltallige spin heeft, zijn deuteriumverbindingen gewild als oplosmiddelen (zogenaamde gedeutereerde oplosmiddelen) voor analyse door middel van kernspinresonantie. Ze interfereren dan niet met de signalen van de te onderzoeken stof. Een veelgebruikt oplosmiddel daartoe is deuteroform (de gedeutereerde vorm van chloroform).
Blauwe waterstof[bewerken | brontekst bewerken]
Blauwe waterstof is het product van grijze waterstofproductie in combinatie met CO2-afvang en -opslag.
Men onderscheidt blauwe waterstof van grijze waterstof (productie uit fossiele bron met toename van broeikasgassen in de atmosfeer) en groene waterstof (uit hernieuwbare bron). Het merendeel van de geproduceerde waterstof is grijze waterstof,[13] door de CO2-uitstoot hierbij af te vangen wordt de productie van deze waterstof CO2-neutraal.
Waterstofproductie met CCS[bewerken | brontekst bewerken]
De meest gebruikte methode voor de productie van waterstof is stoomreforming, en daaraan gekoppelde processen als de water-gas-shift-reactie en drukwisseladsorptie, van methaan-houdende (fossiele) brandstoffen. Bij deze productie ontstaat naast waterstof CO2, die zonder afvang vrijkomt.
CO2-afvang en -opslag, internationaal bekend als Carbon Capture and Storage (CCS), helpt voorkomen dat de CO2 in de atmosfeer terechtkomt. De CO2 wordt bij de productiefaciliteit afgevangen en opgeslagen in bijvoorbeeld lege aardgasvelden onder de zeebodem. Omdat dit al voor de verbranding gebeurt noemt men dit ‘pre-combustion-CCS’.[14] Zo wordt de negatieve invloed op het klimaat door de productie van waterstof uit aardgas voor een belangrijk deel tenietgedaan. Blauwe waterstof is daarmee niet alleen bij het gebruik, maar ook bij de productie grotendeels klimaatneutraal. Dit maakt waterstof, naast het noodzakelijke gebruik als grondstof, ook interessanter om te gebruiken als duurzame brandstof.
Naast het opslaan van de koolstof in gasvorm (CO2) onderzoekt men de mogelijkheden om de koolstof in vaste vorm op te slaan. De methaan uit aardgas of biogas kan ook direct gekraakt worden om waterstof te produceren, waarbij in de afwezigheid van zuurstof alleen pure koolstof als vaste stof overblijft.[15] In vaste vorm is koolstof makkelijker op te slaan, omdat er onder andere geen gevaar voor lekkage bestaat.
Toepassing[bewerken | brontekst bewerken]
De technieken voor CCS bestaan reeds en worden in kleine aantallen toegepast. In Noorwegen bestaat bijvoorbeeld sinds 1996 een infrastructuur voor de opslag van afgevangen CO2 onder de zeebodem.[16] Bij de productie van grijze waterstof is het scheiden van de CO2 reeds een standaard onderdeel van het productieproces, zodat alleen opslag toegevoegd hoeft te worden. De bijkomende kosten die deze opslag met zich meebrengt vormen de voornaamste hindernis voor blauwe waterstof. Daarnaast bestaat er maatschappelijke weerstand tegen de techniek, mede omdat investeringen hierin ten koste zouden gaan van alternatieven voor fossiele brandstoffen.[17]
Waterstof heeft de toekomst: ‘Geen banen verloren, er komt zelfs werkgelegenheid bij’[bewerken | brontekst bewerken]
Groningen gruwt tegenwoordig van de aardgasrijkdom in de bodem, maar de provincie beseft ook dat de chemische industrie en gastechniek die in de provincie is ontstaan, onmisbaar is. Waterstof moet die gaseconomie de komende decennia overeind houden.
Er staat veel op het spel voor Groningen. Afhankelijk van welke deskundige je het vraagt, zijn er hier zo'n 10.000 tot 15.000 banen gemoeid met het aardgas. Daar tel ik dan ook de banen in de chemische industrie die op aardgas draait bij op, zegt de Groningse gedeputeerde Patrick Brouns.
Bron: Waterstof heeft de toekomst: ‘Geen banen verloren, er komt zelfs werkgelegenheid bij’ Ton Voermans 27-06-19, 16:00
- ↑ IPTS-1968
- ↑ Liquid Air/LH2
- ↑ Correspondence and General A-I DEWAR/Box D I
- ↑ (en) interstatetraveler.us
- ↑ (en) fuelcellsworks.com
- ↑ Durability of solid oxide electrolysis cells for hydrogen production
- ↑ Development of solar-powered thermochemical production of hydrogen from water
- ↑ (en) Well-to-wheels greenhouse gas emissions and petroleum use for mid-size light-duty vehicles
- ↑ hydrogen storage cavern system
- ↑ 1994 - ECN abstract (gearchiveerd)
- ↑ Energy technology analysis.Pag.70 (gearchiveerd)
- ↑ Understanding protein hydrogen bond formation with kinetic H/D amide isotope effects Nature Structural Biology 9, 458 - 463 (2002) Bryan A. Krantz, Alok K. Srivastava, Sehat Nauli, David Baker, Robert T. Sauer & Tobin R. Sosnick Published online: 29 april 2002; | doi:10.1038/nsb794
- ↑ Hydrogen Generation Market Size, Share & Trends Analysis Report By Application (Coal Gasification, Steam Methane Reforming), By Technology, By System (Merchant, Captive), And Segment Forecasts, 2018 - 2025, Grand View Research, juni 2018, geraadpleegd 15-03-2019
- ↑ Waterstof en CCS: een slimme combinatie, GasTerra, 1 februari 2018, geraadpleegd 15-03-2019
- ↑ Russia Looks to Hydrogen as Way to Make Gas Greener for Europe, Bloomberg, 8 november 2018, geraadpleegd 15-03-2019
- ↑ Carbon capture and storage, NorskPetroleum.no, 16 april 2015, geraadpleegd 15-03-2019
- ↑ CO2</sub opslaan onder de grond: een goed idee of niet?, NOS, 19 juni 2018, geraadpleegd 15-03-2019



